目前,慢性肾脏病的全球发病率超过10%,其中90%是由肾小球疾病导致,足细胞损伤是肾小球疾病的中心环节,肾小球疾病时足细胞受损是导致蛋白尿、肾小球硬化及肾功能进行性恶化的病理生理基础。探寻足细胞损伤新机制,以寻找有效的治疗靶点纠正足细胞功能紊乱,对于防治慢性肾病具有重要意义。成熟肾脏肾小球足细胞间紧密连接结构消失,但免疫荧光和免疫电镜等技术分析表明紧密连接跨膜蛋白CLDN5在成熟足细胞组成性表达,对于CLDN5在足细胞的生物学功能以及是否参与肾小球疾病发生发展一直缺乏深入研究。
2022年3月24日,我院肾脏生理与疾病研究团队在Nature Communications在线发表了题为:Loss of CLDN5 in podocytes deregulates WIF1 to activate WNT signaling and contributes to kidney disease 的研究论文。该研究首次揭示了足细胞紧密连接跨膜蛋白CLDN5可调控WNT通路抑制分子WIF1的表达并参与肾脏病发生发展。

在该研究中,研究人员利用ES打靶构建了首个CLDN5 LOXP基因修饰小鼠模型,并进行了足细胞特异性基因敲除。与野生型小鼠相比,CLDN5基因缺陷型糖尿病肾病显著加重,表现为蛋白尿加重、足突融合、基底膜增厚、足细胞标志分子表达降低及间质纤维化加重。除了糖尿病肾病模型,研究人员发现足细胞CLDN5缺失也加重了小鼠单侧输尿管梗阻诱导急性肾损伤后纤维化进程。这些表型说明足细胞CLDN5在肾脏疾病中起着保护作用。
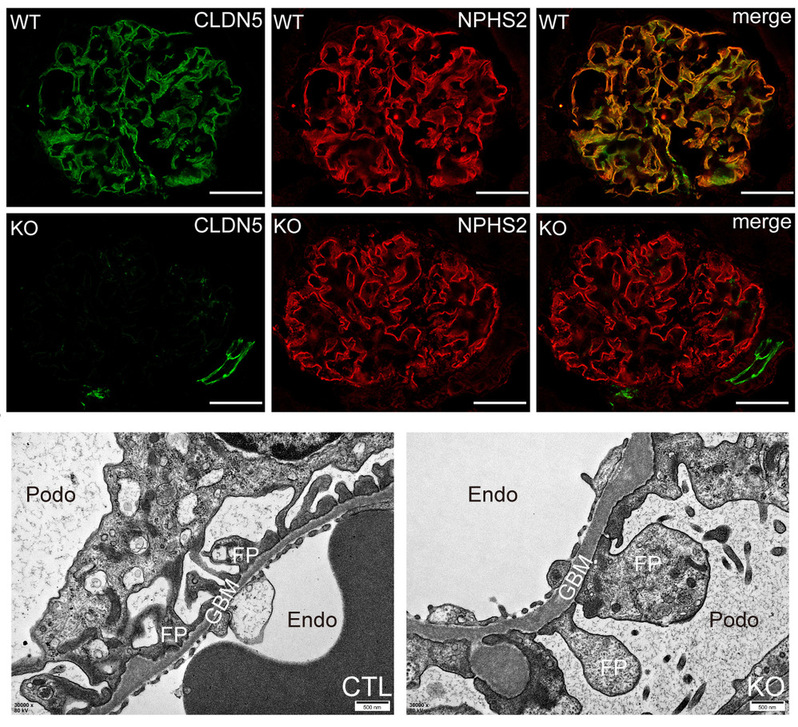
研究人员还发现该保护作用主要是通过足细胞分泌的WNT通路抑制分子WIF1的参与实现的。不管是稳态下还是肾病环境下,在CLDN5缺失的小鼠中,足细胞WIF1表达均受到抑制,补充WIF1蛋白表达可减缓糖尿病肾病疾病的进展,提示WIF1有可能成为一个新的慢性肾脏病治疗靶点。为了进一步探究足细胞CLDN5对WIF1表达的调控作用,研究者还构建了WIF1 LOXP基因修饰小鼠模型,发现足细胞特异性WIF1基因敲除小鼠复制CLDN5敲除小鼠表型,同时也加剧了小鼠糖尿病肾病症状及急性肾损伤后纤维化进程。这些发现表明足细胞CLDN5影响WIF1表达进而发挥其生物学作用。
利用免疫共沉淀、亚细胞组分分离、免疫荧光共定位及荧光素酶报告基因检测等实验方法,研究人员证实CLDN5在正常足细胞中与ZO1和转录因子ZONAB形成复合物,并且该复合物可维持ZONAB的细胞膜定位。足细胞CLDN5缺失可通过影响ZO1表达水平导致ZONAB发生核转位,ZONAB与WIF1的3’UTR区相互作用进而调控WIF1基因表达。

这项工作是世界首次发现紧密连接跨膜蛋白CLDN5在细胞旁路通透性调控等之外的新功能,对于进一步理解这个家族的生物医学特性及其在相关疾病中的作用和机制具有重要意义,也揭示了CLDN5和WIF1作为肾脏病治疗新靶点的重要意义。
生理教研室孙晖副教授、2018级研究生李慧和燕杰为该论文的第一作者,巩永凤教授为本文的通讯作者。本研究由国家自然科学基金面上项目、山东省泰山学者特聘专家计划及滨州医学院科研启动基金等多个项目提供支持。
原文链接:
https://www.nature.com/articles/s41467-022-29277-6
